|
Canales Iónicos
Características y tipos de canales iónicos. Medidas de conductancia mediante la técnica de “Patch-Clamp”. Permeabilidades relativas y selectividad. Propiedades moleculares de los canales iónicos de reposo. Propiedades moleculares de los canales iónicos regulados por voltaje. Sensibilidad al voltaje de los canales de sodio y potasio regulados por voltaje. Ciclo de funcionamiento de un canal de Na+ regulado por voltaje
CARACTERÍSTICAS Y TIPOS DE CANALES IÓNICOS
Al contrario de las proteínas transportadoras, los canales proteicos forman simplemente poros abiertos en la membrana, permitiendo a moléculas de tamaño y carga apropiados pasar libremente a través de la bicapa lipídica. Un grupo de estas proteínas son las porinas, que permiten el libre paso de iones y pequeñas moléculas polares a través de la membrana exterior de bacterias. La membrana plasmática de muchas células también contienen canales proteicos de agua, que permiten a las moléculas de agua cruzar la membrana mucho más rápidamente de lo que puede difundir a través de la bicapa fosfolipídica.
Sin embargo, los canales proteicos mejor caracterizados son los canales iónicos, que median el paso de iones a través de la membrana plasmática. Aunque dichos canales se encuentran en las membranas de todas las células, se han estudiado especialmente en el nervio y el músculo, donde su apertura y cierre regulados son responsables de la transmisión de señales eléctricas.
Propiedades de los canales iónicos relevantes para su función:
- Canales regulados por ligandos: abren en respuesta a la unión de determinados neurotransmisores u otras moléculas
- Canales regulados por voltaje: abren en respuesta a cambios en el potencial eléctrico a través de la membrana plasmática
- Canales regulados por un impulso mecánico: abren en respuesta a una acción mecánica
El papel fundamental de los canales iónicos regulados por voltaje en la transmisión de impulsos eléctricos fue elucidado como mencionamos en el capitulo anterior por Alan Hodgkin y Andrew Huxley en 1952.
MEDIDAS DE CONDUCTANCIA MEDIANTE LA TÉCNICA DE PATCH-CLAMP
La técnica de "Patch-Clamp", o medida de la conductividad a través de un canal individual, ha permitido investigar la apertura, cierre y conductancia de iones en canales iónicos individuales, es decir de una proteína de membrana plasmática individual. La técnica fue introducida por Erwin Neher y Bert Sakmann en 1976, por lo cual recibieron el Premio Nobel.
|
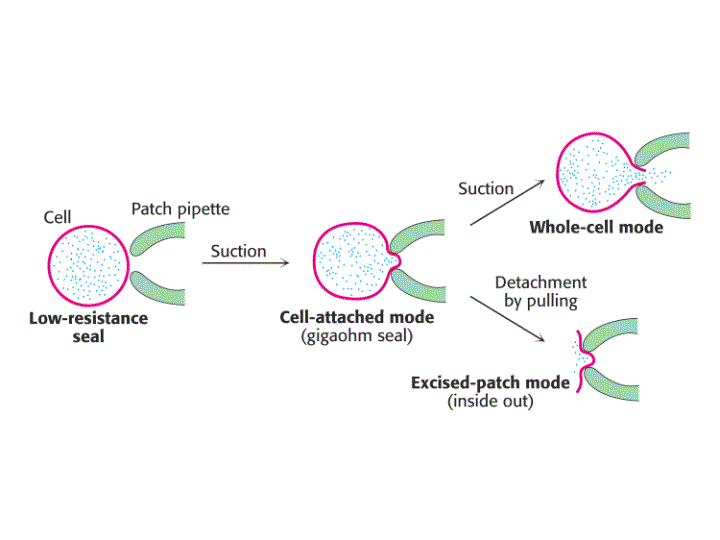
Una pipeta de vidrio limpia con un orificio terminal de una micra de diámetro se presiona contra una célula intacta quedando cerrada por adherencia. Una ligera succión da lugar a la formación de un cierre hermético, de modo que la resistencia entre el interior de la pipeta y la disolución externa es de muchos gigaohmnios (109 ohmnios). Este cierre de gigaohmnios (llamado gigaseal) asegura que la corriente eléctrica que fluye a través de la pipeta sea idéntica a la corriente que fluye a través de la membrana que cubre el extremo de la pipeta. El gigaseal permite realizar mediciones de corriente con alta resolución cuando se aplica a través de la membrana un voltaje conocido.
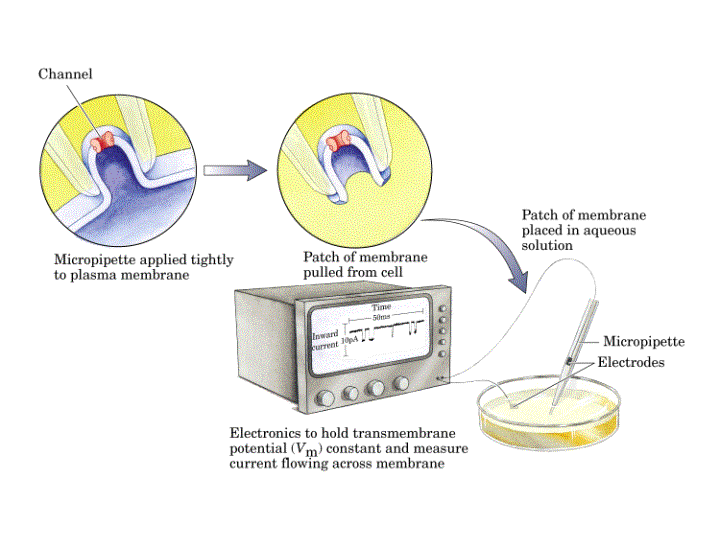
En sí, es un artilugio que permite mantener constante el voltaje a través de la membrana y medir el flujo de corriente en el parche de membrana que queda en la punta de la micropipeta. En general la membrana se despolariza e hiperpolariza eléctricamente mientras se mantiene a un potencial determinado. El movimiento de iones hacia adentro o fuera cruzando la membrana puede ser cuantificado a partir de la cantidad de corriente eléctrica necesaria para mantener el potencial de membrana en el valor determinado. Para asegurar la electroneutralidad, la entrada de cada ion de carga positiva en la célula se balancea con la entrada de un electrón en el citosol a través del electrodo que se ha colocado en él.
Por tanto, nos permite medir la Conductancia, g = i / (Y - Yr). (i = intensidad de corriente. Y = potencial al que se fija la membrana. Yr = potencial de reversión, al que la mitad de los conductos están abiertos y la mitad cerrados). Se expresa en siemens (inverso de ohmnio)
La técnica de "Patch-Clamp" puede utilizarse de formas diferentes, proporcionando distintos tipos de información.
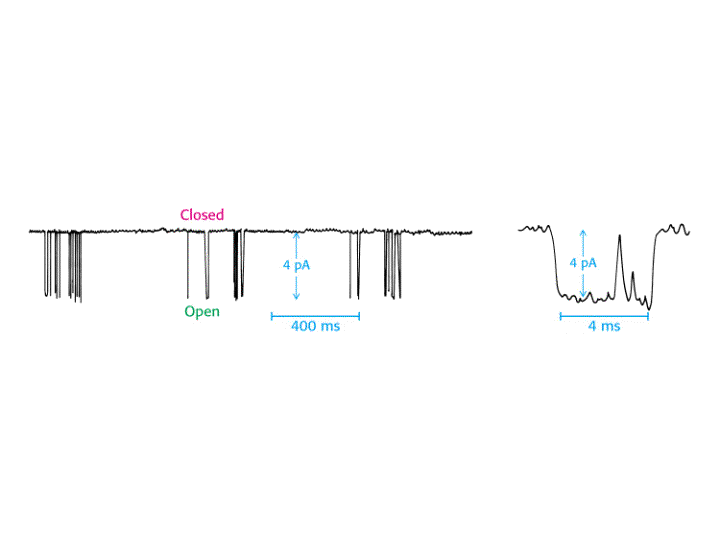
Ejemplo: Registros de Patch-Clamp de un único conducto del receptor de acetilcolina situado en la membrana postsináptica del músculo esquelético. La adición de acetilcolina va seguida de la apertura transitoria del conducto. i, corriente que fluye a través del canal abierto (4 pA) cuando el potencial de membrana es de -100 mV. Un amperio corresponde a un flujo de 6.24x1018 cargas por segundo. Por tanto, el flujo a través de un conducto abierto es de 2.5x107 iones Na+ por segundo. Yr es el potencial de reversión en el cual no hay flujo neto, 0. g = 40 pS.
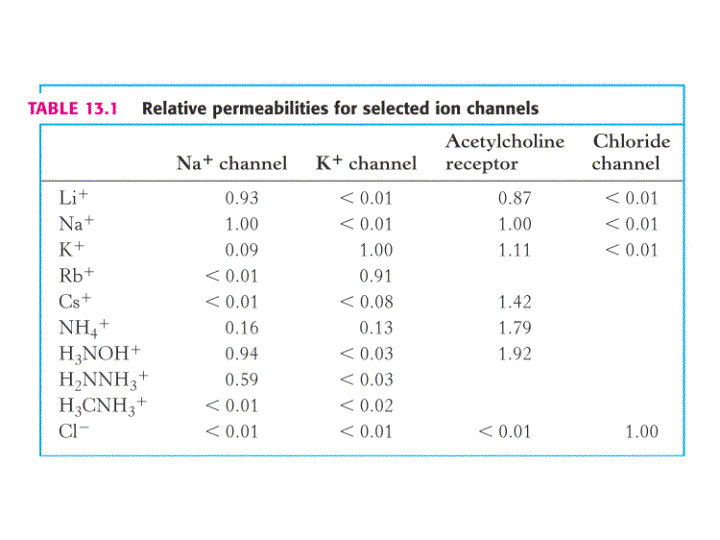
PERMEABILIDADES RELATIVAS Y SELECTIVIDAD
Los conductos o canales iónicos son altamente selectivos.
Canales iónicos de Na+
Los canales iónicos de Na+ facilitan unas 11 veces más el paso del ión Na+ que el del ión K+. En este caso, la dependencia de la permeabilidad con respecto al tamaño iónico demuestra que los conductos son estrechos. En el caso de un canal de Na+ los iones cuya esfera de hidratación presenta un diámetro superior a 5 Å quedan excluidos.
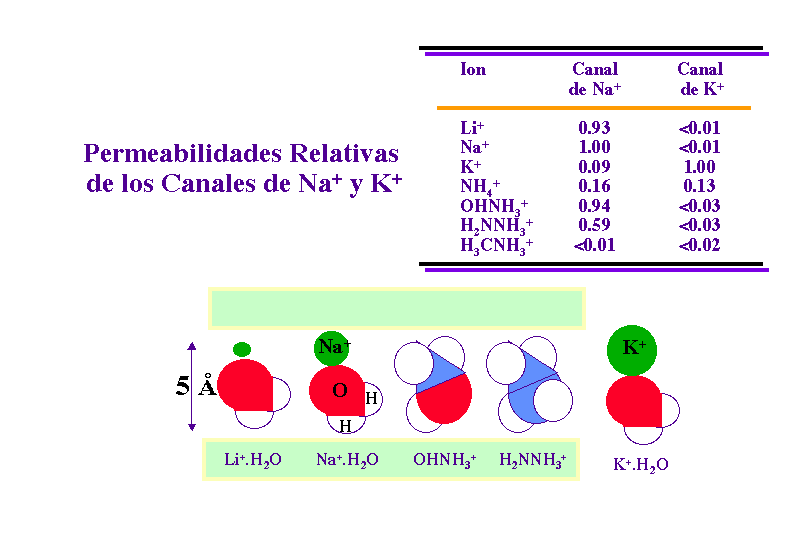
Sin embargo, la conductancia no depende sólo del tamaño. Por ejemplo, la metilamina tiene aproximadamente las mismas dimensiones que la hidracina y la hidroxilamina, y el canal es mucho menos permeable a la metilamina. Esto ha de deberse a que el metilo de la metilamina no puede formar puentes de hidrógeno con un átomo de oxígeno situado en la parte estrecha del poro, el filtro de selectividad.
Además, se ha comprobado que la conductancia del canal de Na+ disminuye cuando baja el pH, siguiendo la permeabilidad relativa una curva de valoración de un ácido con un pK de 5.2. Esto sugiere que la forma activa del canal contiene un grupo carboxilato cargado negativamente.
Por tanto, el canal de Na+ selecciona el Na+ porque contienen un centro cargado negativamente con un radio pequeño. El ión K+ no puede pasar por este filtro de selectividad porque es mayor que el Na+
.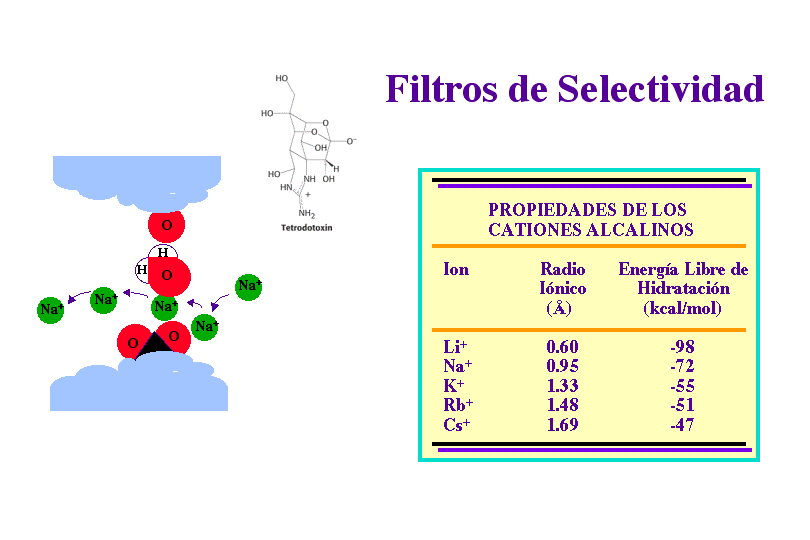
Canales iónicos de K+
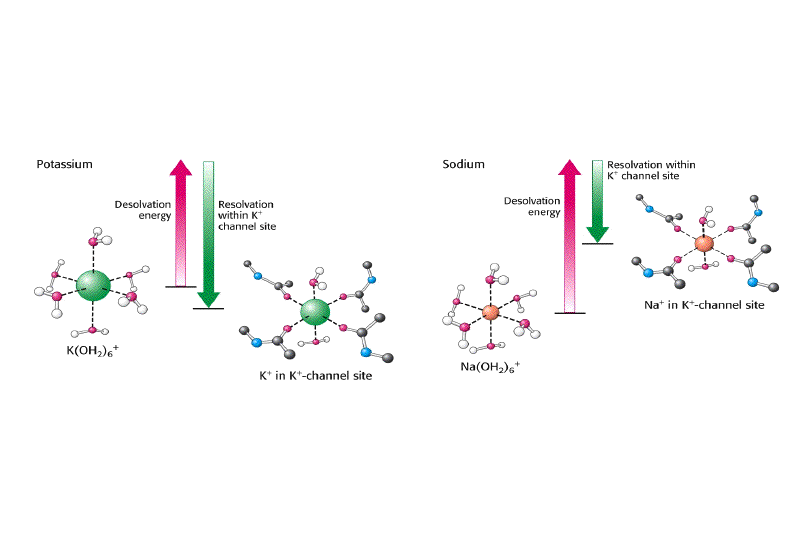
Los canales de K+ son 100 veces más permeables al K+ que al Na+. El filtro de selectividad del canal de K+, de solo 3 Å, permite rechazar iones con radio mayor de 1.5 Å. Sin embargo, el ión Na+ desnudo sería suficientemente pequeño para atravesar el poro.
Sin embargo, este canal no puede ser atravesado por los iones cuando están rodeados de moléculas de agua. El costo de energía libre para la deshidratación de Na+ es mayor que para la de K+. El canal paga la mayor parte del coste de deshidratación del K+ suministrando interacciones compensatorias con átomos de oxígeno que revisten el filtro de selectividad, estos átomos están localizados de manera que no interaccionan tan favorablemente con el Na+. Por tanto, el canal de K+ evita el acoplamiento con el Na+, no dándole opción para deshidratarse y resultando por tanto impermeable a este ion.
PROPIEDADES MOLECULARES DE LOS CANALES IÓNICOS DE REPOSO
La estructura tridimensional de un canal de K+ de reposo de la bacteria Streptomyces lividans se determinó por primera vez por difracción de Rayos-X en 1998. Dicha estructura proporciona gran información de cómo trabajan estos canales. Este canal iónico bacteriano presenta gran homología en secuencia con casi todos los canales iónicos conocidos, sirviendo de prototipo estructural, incluyendo también a los canales iónicos regulados por voltaje.
Entre los miembros de esta familia de proteínas, la homología en secuencia es mayor en la región del poro del canal, que contiene el filtro de selectividad, y permite al K+ atravesarlo 10.000 veces más que al Na+ y con una velocidad que se aproxima al limite teórico para una difusión no restringida.
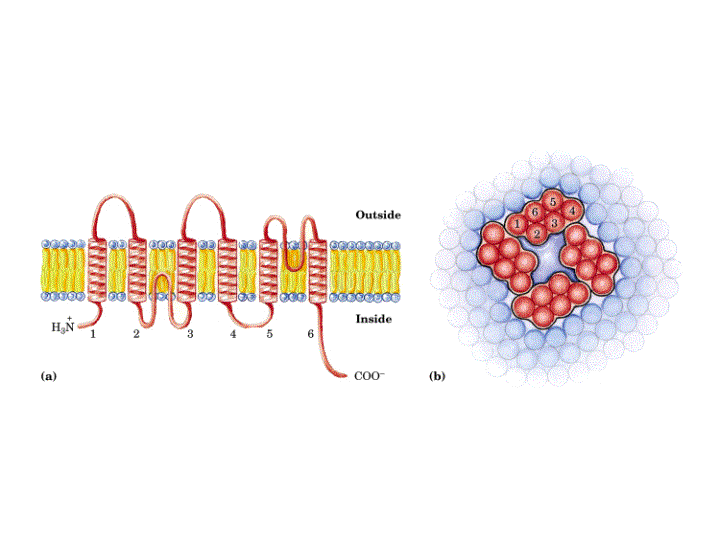
El canal de K+ consiste en cuatro subunidades idénticas que atraviesan la membrana y forman un cono con la parte más ancha enfocada hacia el espacio extracelular. Cada subunidad tiene dos hélices a transmembranales y una tercera hélice a mas corta que forma parte de la región del poro. La parte exterior del cono es formada por una hélice a tranmembranal de cada subunidad. La parte interior del cono, formada por las otras cuatro hélices transmembrana rodea el canal iónico y forma el filtro de selectividad del ión.
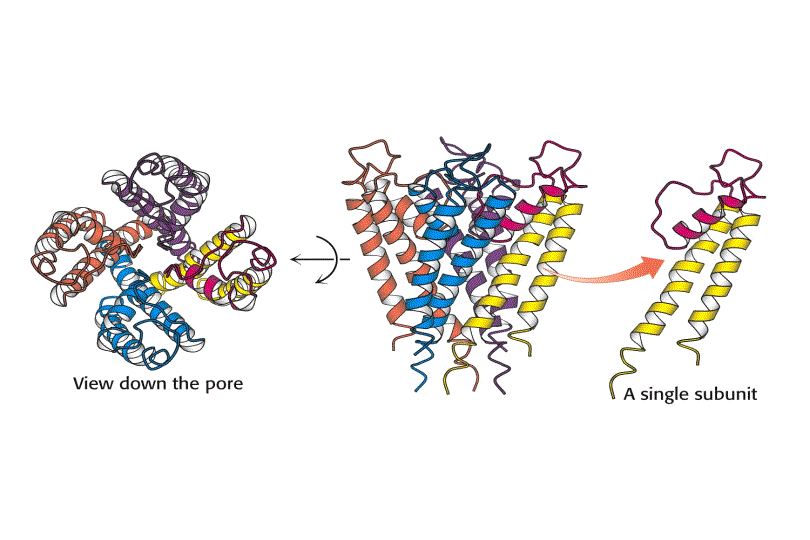
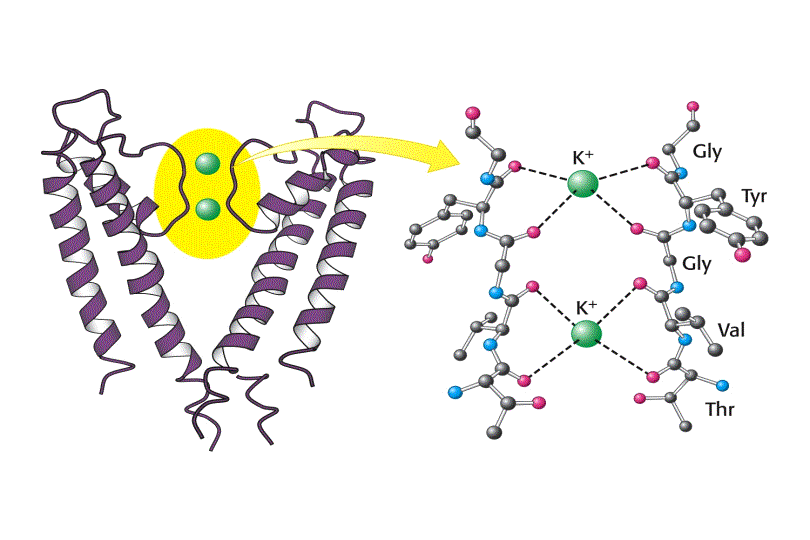
Tanto la especificidad como el alto flujo de iones a través del canal se entienden una vez conocida su estructura. En las superficies interior y exterior de la membrana, se encuentran una serie de aminoácidos cargados negativamente, los cuales presumiblemente aumentan la concentración local de cationes. El camino de los iones comienza en la superficie interior que es un canal ancho lleno de moléculas de agua donde el ion puede retener su esfera de hidratación. Las hélices cortas proporcionan mayor estabilización del catión en esa posición con sus extremos carboxilo terminales apuntando a los iones potasio que se encuentran dentro del canal. A dos tercios de su interior en la membrana el interior del canal se estrecha en la región del filtro de selectividad, forzando al ión a separarse de las moléculas de agua que lo hidratan. Átomos de oxigeno de los grupos carbonilo de la cadena principal en el filtro de selectividad reemplazan a las moléculas de agua en la esfera de hidratación del K+, formando una serie perfecta de esferas de coordinación a través de las cuales se mueve el ión. La estabilización preferente del K+ frente al Na+ es la base de la selectividad por el ion de este filtro, y mutaciones en esta zona eliminan la selectividad del canal.
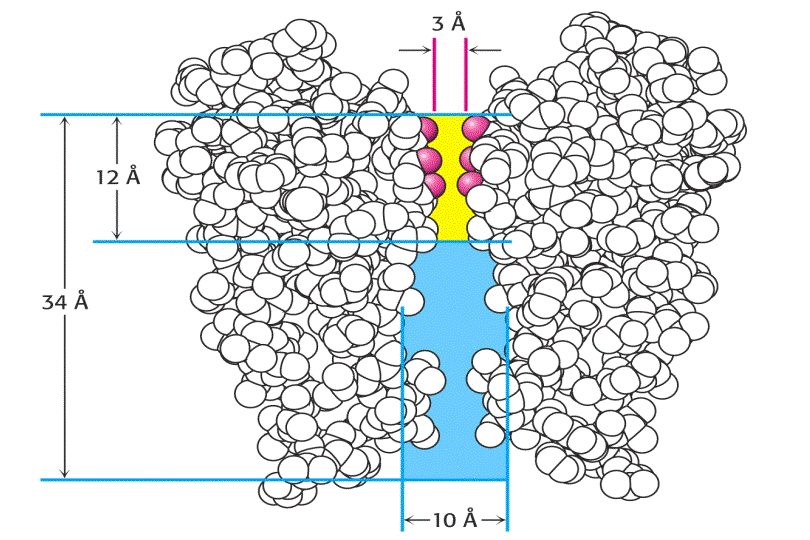
Los iones pasan a través del filtro en fila individual. En la estructura cristalográfica, dos iones K+ son visibles, cada uno en un extremo del filtro de selectividad separados por 7.5Å. Su mutua repulsión electrostática ha de ser posiblemente la causa de su balance de interacción con el filtro de selectividad, manteniendo su rápido movimiento.
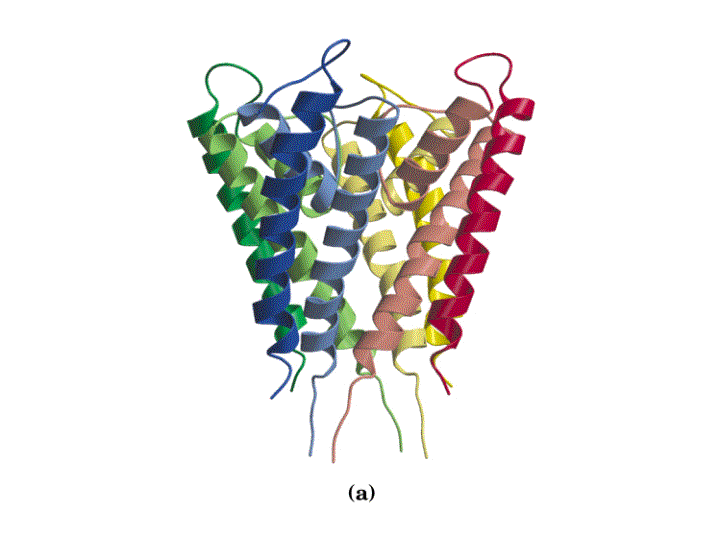
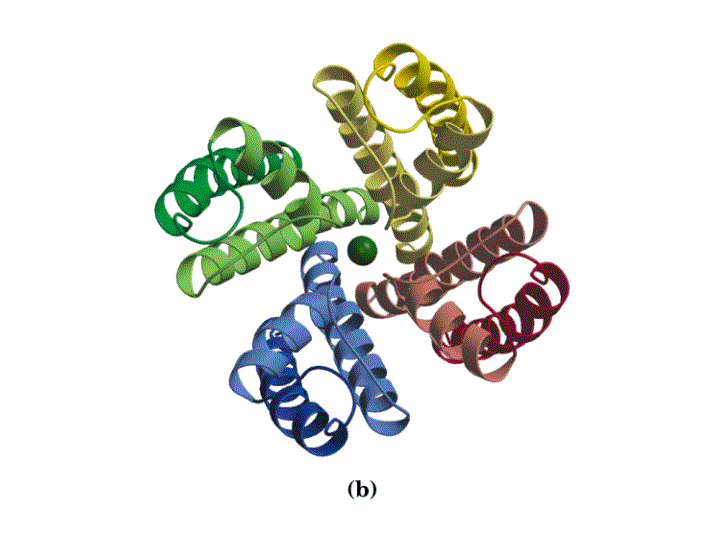

Otros canales de K+ de reposo son similares a este en secuencia y, por tanto, presumiblemente en estructura y mecanismo. Además, la secuencia de aminoácidos de los canales de Na+ y Ca2+ sugieren que dichos canales también comparten similitudes estructurales y funcionales con este canal de K+ de reposo de bacterias.
PROPIEDADES MOLECULARES DE LOS CANALES IÓNICOS REGULADOS POR VOLTAJE
Tres propiedades de los canales iónicos regulados por voltaje permiten a las células nerviosas conducir impulsos eléctricos:
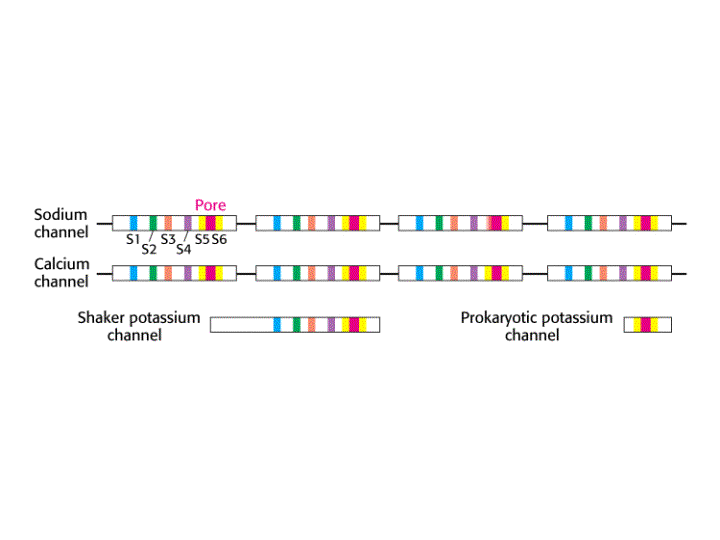
Todos los tipos de canales iónicos regulados por voltaje han sido clonados, encontrándose que todos ellos presentan una estructura primaria, y posiblemente secundarias y terciarias, sorprendentemente similar. Por el momento no se dispone de la estructura tridimensional de ninguno de estos canales.
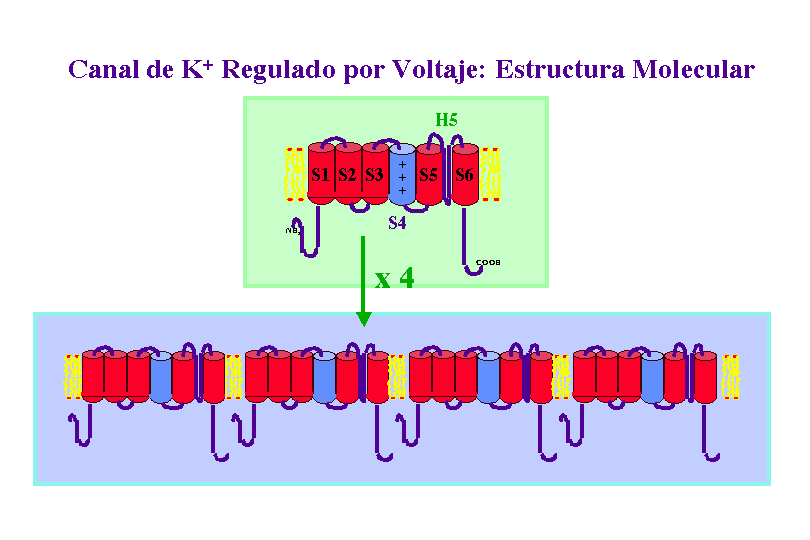
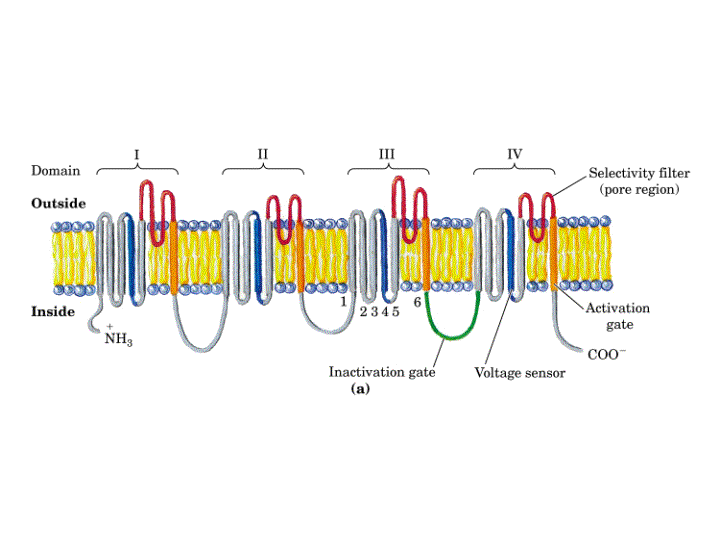
Un típico canal de K+ regulado por voltaje contiene cuatro copias de un polipéptido de unos 656 aminoácidos, cada uno de estos polipéptidos presenta seis a-hélices transmembranales, que se nombran de S1 a S6, un segmento H5, que forma el poro del canal y un segmento N-terminal que forma "la bola" o segmento inactivador del canal, el cual se mueve para obturar poro del canal inactivándolo. Un canal de K+ funcional esta constituido por cuatro copias de este polipéptidos.
Los canales de Ca2+ y Na+ regulados por voltaje están constituidos por un solo polipéptido de unos 2000 aminoácidos, que contiene cuatro dominios transmembranales homólogos, siendo cada uno de ellos similar en secuencia y estructura a cada una de las proteínas individuales del canal de K+ regulado por voltaje. Estos dominios se encuentran unidos por cortas cadenas de residuos no homólogos.
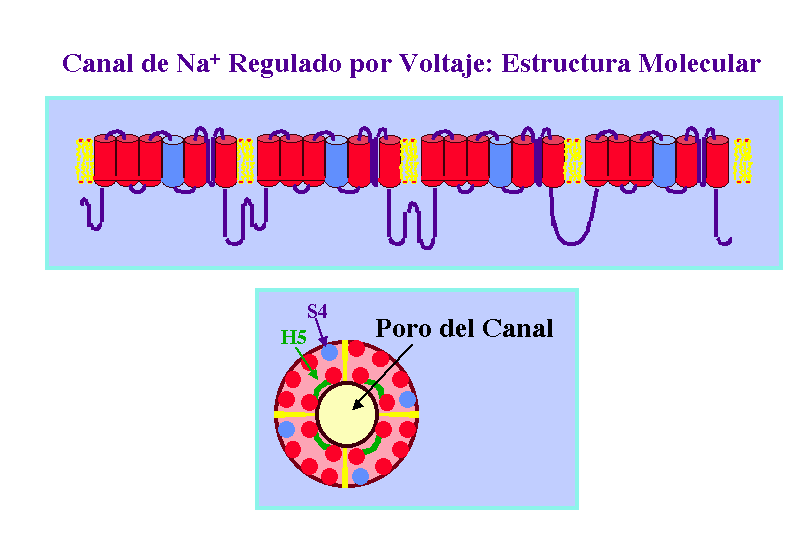
Estudio de Canales Mutantes. Expresión en Oocitos
El estudio de canales mutantes resistentes a una neurotoxina que cierra la entrada de los canales permitió la identificación de los aminoácidos que se encuentran en el poro del canal de potasio.
Posteriormente, el empleo de la técnica de mutagénesis dirigida en uno de los varios residuos del segmento H5 demostro la inhibición de la unión de la toxina. De esta forma, cuando el canal era expresado en Oocitos resultaba resistente a la inhibición por la toxina. Por tanto, se concluyó que la región H5 del canal constituía el poro de paso de los iones. Según esto la región del poro es muy pequeña, 20-30 residuos, lo que sugiere que un canal funcional se ha de constituerse por varios polipéptidos. De nuevo, la expresión en Oocitos de canales nativos y resistentes a toxinas, junto con mezcla de ellos, llevó a la conclusión que la proteína del canal de K+ regulado por voltaje era un tetrámero. Esto es de esperar, ya que concuerda con el hecho de que los canales de Na+ y Ca2+ están constituidos por un simple polipéptido que corresponde con la suma de cuatro del canal de K+.
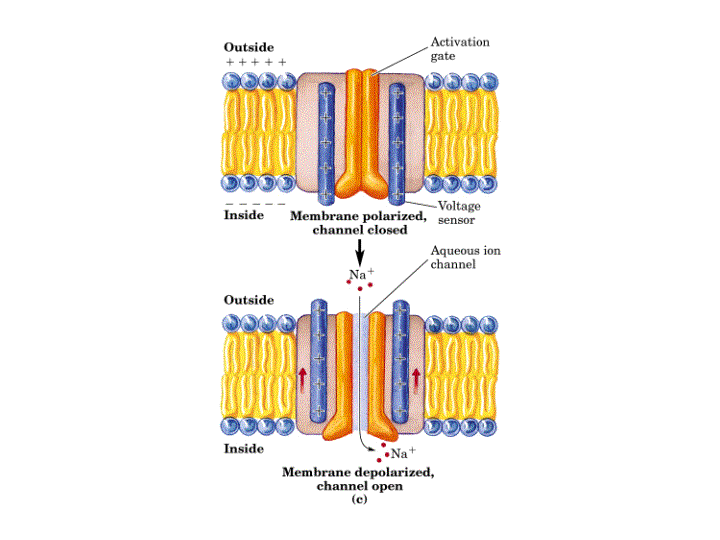
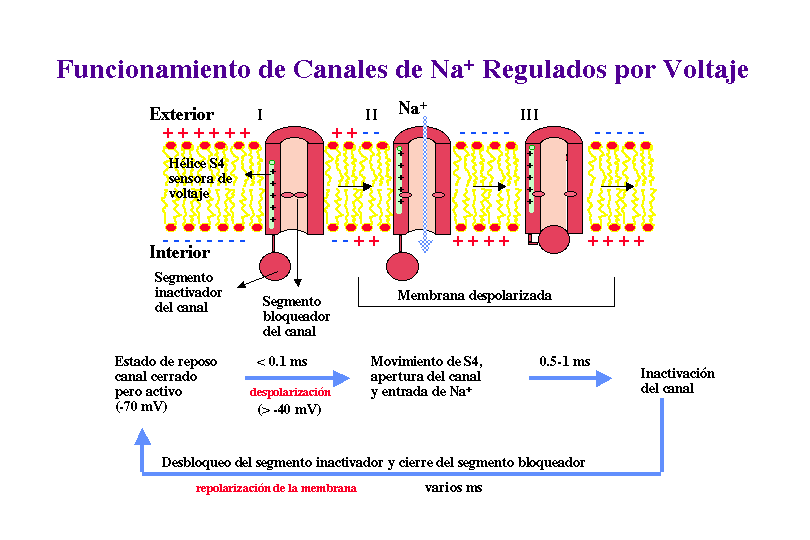
Ya que los canales regulados por voltaje se abren cuando se produce una despolarización de la membrana, algún segmento del canal debe ser el sensor de voltaje que detecta el cambio en potencial. Medidas eléctricas sugieren que la apertura de los canales va acompañada del movimiento de entre cuatro-seis cargas positivas unidas a la proteína canal desde el citosol a la superficie exoplásmica de la membrana. El movimiento de estas cargas, o sensores de voltaje, bajo la fuerza del campo eléctrico se cree que induce un cambio conformacional en la proteína que abre el canal. Se piensa que este sensor de voltaje es la hélice-a transmembranal S4, que se encuentra en todos los canales iónicos regulados por voltaje. Este segmento S4, normalmente llamado hélice-a reguladora, presenta múltiples residuos con carga positiva. Se propone que cuando la membrana resulta despolarizada estos aminoácidos se mueven hacia la cara exoplasmática del canal. El papel de la hélice S4 ha sido confirmado por estudios de mutagénesis dirigida preparando mutantes sobre los residuos de arginina y lisina de esta hélice a, expresando los canales mutantes en oocitos y estudiando sus respuestas por "patch-clamp". Se observo que cuanto menos cargas positivas hay en esta hélice a, mayor debía de ser la despolarización para que el canal se abriera.
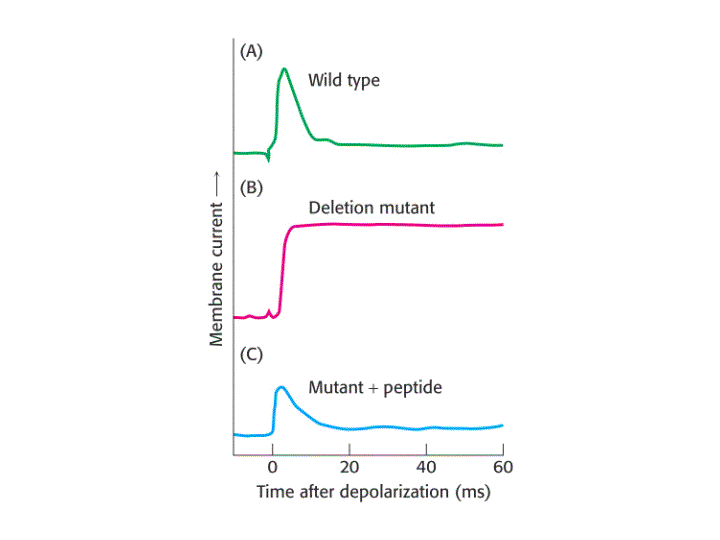
Otra característica importante de los canales regulados por voltaje es la inactivación, ya que rapidamente después de su apertura se cierran espontáneamente. El polipéptido que forma la parte N-terminal (en K+) o una de las zonas que conecta las subunidades en el interior celular (en Na+), forma una "bola" globular que entra en el canal abierto inactivándolo. Estudios de mutagénesis dirigida en los que se ha eliminando el péptido que constituye dicha bola confirman este mecanismo, el cual ha sido denominado Modelo de la cadena de presidiario.
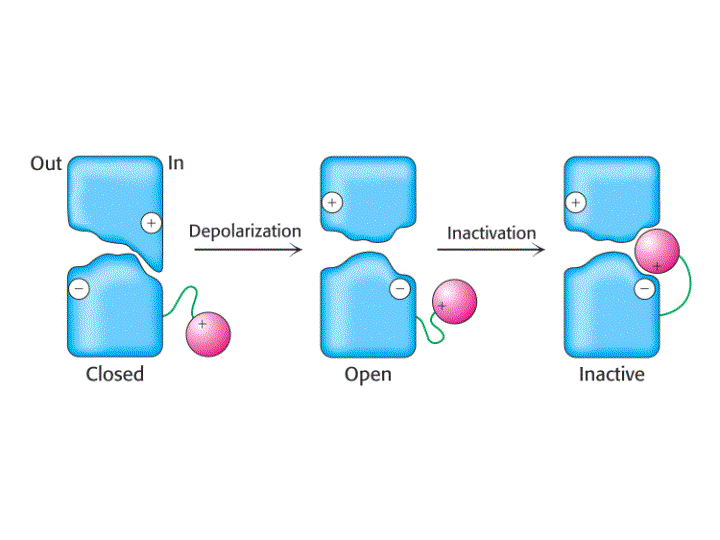
En resumen, los canales iónicos regulados por voltaje contienen cuatro repeticiones internas que poseen secuencias de amino ácidos semejantes que llevan a las siguientes similitudes entre los distintos tipos de canales iónicos:
-Los canales de Na+, K+ y Ca2+ se abren cuando la membrana se despolariza.
-La hélice S4, que es el sensor de voltaje, presenta cargas positivas cada tres o cuatro residuos.
-Las proteínas de los canales de Na+ y Ca2+ presentan gran homología de secuencia. Cada una contiene cuatro dominios transmembranales con seis hélices-a y un segmento del poro H5 por dominio. La secuencia y estructura transmembranal de los canales de K+ es similar a aquellas de cada dominio de un canal de Na+ o Ca2+. Cada canal de K+ contiene cuatro copias del polipéptido.
-Todos estos canales tienen una secuencia H5 formadora del poro en una posición similar.
Estas similitudes entre los canales de Na+, K+ y Ca2+ regulados por voltaje sugieren que las tres proteínas han evolucionado de un gen ancestral común. Posiblemente las proteínas del canal de K+ aparecieron primero y las otras surgieron posteriormente por duplicación repetitiva de un dominio de un gen ancestral del canal de K+.
Modelo esquemático de un canal iónico regulado por voltaje

Actualmente se propone que los canales iónicos regulados por ligando deben presentar una estructura similar a estas, pero en estos casos la hélice S4 no funciona como sensor de voltaje, tienen el poro H5 y en el segmento que se encuentra el citosol tienen un sitio que une el ligando que inducirá la apertura o cierre del canal..
Los estudios de las denominadas cargas reguladoras de paso han revelado la existencia de al menos tres estados cerrados que preceden al estado abierto. El estado abierto dura solo alrededor de 1 ms porque se convierte espontáneamente en un estado inactivo. La vuelta al estado cerrado pero activable requiere la repolarización. Así, el canal se cicla unidireccionálmente durante un potencial de acción.
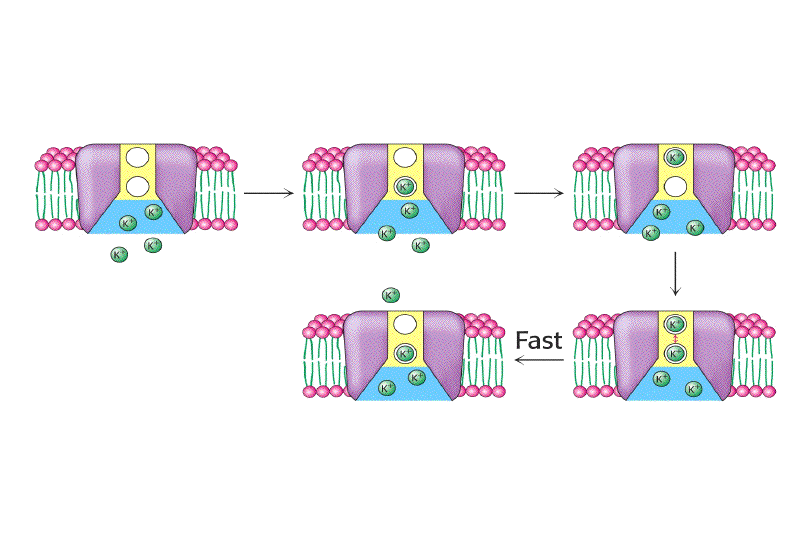
CICLO DE FUNCIONAMIENTO DE UN CANAL DE Na+ REGULADO POR VOLTAJE
Por tanto, la información de la que actualmente se dispone permite en este momento proponer el siguiente mecanismo cíclico para el funcionamiento de un canal de Na+ regulado por voltaje:
Bibliografía
|
Página creada y mantenida por Milagros Medina
Última modificación 20 de Marzo de 2007